聚焦前沿·科研仪器系列讲座(九)超高分辨显微镜和多模态活细胞系统
2022年3月22日,科技中心基础研究部临床医学研究所举办了题目为“超高分辨显微镜和多模态活细胞系统”的学术讲座。讲座由郭静和王在老师组织举办,线上进行。本场讲座邀请徕卡公司生命科学部高级应用专员刘继红,分别对超高分辨显微镜、多模态活细胞系统的技术原理及科研应用情况进行了全面的介绍讲解。
超高分辨显微镜
超高分辨率技术是目前光学显微镜领域最先进和最有发展前景的技术。自从1873年德国物理学家恩斯特-阿贝(ErnstAbbe)第一次发现光学成像具有衍射限制现象以来,200nm的“阿贝极限”一直被认为是光学显微镜理论上的分辨率极限,小于这个尺寸的物体必须借助电子显微镜才能观察。德国物理学家StefanHell开发的STED技术(StimulatedEmissionDepletion,受激发射损耗)突破了衍射极限的限制。2014年StefanHell凭借STED超高分辨显微技术,获得诺贝尔化学奖。
STED是搭载在共聚焦平台上纯光学的超高分辨率技术,不依赖于数学计算,所见即所得。STED受激发射系统中需要两束照明光,其中一束为激发光,另外一束为损耗光。当激发光的照射使得其衍射斑范围内的荧光分子被激发,其中的电子跃迁到激发态后,损耗光使得部分处于激发光斑外围的电子以受激发射的方式回到基态,其余位于激发光斑中心的被激发电子则不受损耗光的影响,继续以自发荧光的方式回到基态。由于在受激发射过程中所发出的荧光和自发荧光的波长及传播方向均不同,因此真正被探测器所接受到的光子均是由位于激发光斑中心部分的荧光样品通过自发荧光方式产生的。由此,有效荧光的发光面积得以减小,从而提高了系统的分辨率。
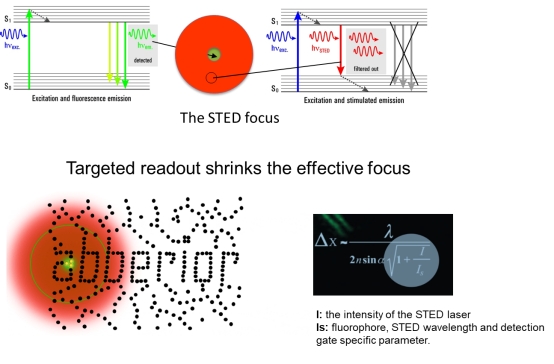
徕卡公司在STED技术上继续深入开发,于近年推出τ-STED系统,结合荧光寿命τ的时间维度及STED的空间维度,成功将分辨率提升至30nm以下,并且实现时间、空间双重维度的超高分辨成像。
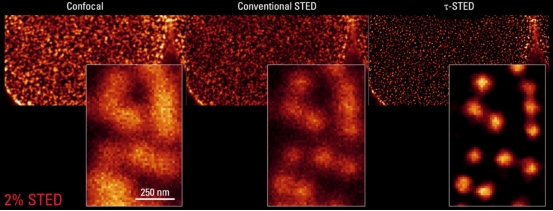
STED特别适合应用于组织和细胞内微小结构和物质的观察,如膜蛋白与膜微结构域、细胞器内部的微小结构、细胞骨架结构、神经元突触、细菌内部的物质结构等等。实验证明,STED超高分辨率显微技术能很好地胜任介于光镜与电镜分辨率之间的结构和物质的观察。
多模态活细胞系统
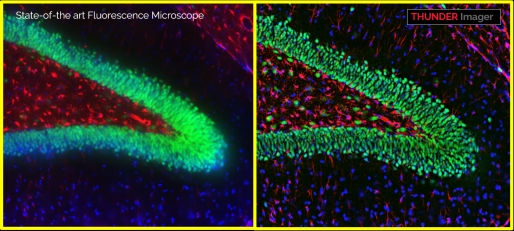
徕卡公司今年新推出的多模态活细胞系统MICA结合宽场高清晰THUDNER技术及共聚焦高清晰LIGHTNING技术,可在宽场及共聚焦模式下快速切换,从而实现活细胞的高速高分辨观察。
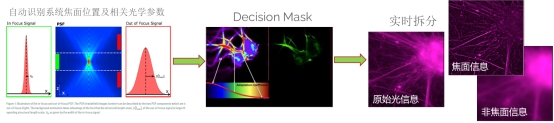
其中THUNDER技术为近年徕卡公司推出的新技术,广泛应用于正置、倒置及体视显微镜中,通过专利的ComputationalClearing方法去除所有厚样本的宽场图像固有的焦外模糊信号。自动识别系统所有位置及光学参数,采用DecisionMask自动根据信噪比与当前光学参数抽出焦面信号。
此外,MICA系统具备自动寻找样品、自动对焦、自动扫描等功能,可进行组织切片样品快速扫描成像,也可进行活细胞类样品长时间动态观察,其密闭的箱体结构可保持环境的稳定性。采用FluoSync光谱拆分技术可实现同时四色成像,实现不同颜色的荧光通道的时空达到统一。通过简化整个工作流程,减少研究样品所需的时间和精力,内置AI软件分析模块,通过人工智能辅助分割不同样品结构,在整个实验过程中实现100%的重现性和可重复性。
上一篇:
下一篇:

